Frumeind

Frumeind eða atóm er smæsta aðgreinanlega eining frumefnis, sem jafnframt hefur efnafræðilega eiginleika þess til að bera. Frumeind er þannig grundvallareining efna og helst óbreytt í efnahvörfum. Hver frumeind er úr þremur gerðum einda: Frumeindakjarni er gerður úr nifteindum sem ekki hafa rafhleðslu og róteindum sem eru jákvætt hlaðnar. Umhverfis kjarnann eru rafeindir sem eru með neikvæða hleðslu. Frumefnin eru skilgreind út frá fjölda róteinda í kjarnanum. Allar frumeindir sem hafa 11 róteindir í kjarna, sem dæmi, eru þannig natrínfrumeindir, og allar frumeindir sem eru með 29 róteindir eru koparfrumeindir. Frumeindir með sama fjölda róteinda en mismunandi fjölda nifteinda eru kallaðar samsætur (ísótópar) sama frumefnis.
Frumeindir eru að jafnaði um 100 píkómetrar í þvermál. Eitt mannshár er jafnbreitt og um milljón kolefnisfrumeindir. Frumeindir eru smærri en minnsta bylgjulengd sýnilegs ljóss, sem þýðir að menn geta ekki greint frumeindir í hefðbundnum smásjám. Þær eru svo smáar að sígild eðlisfræði nægir ekki til að skýra hegðun þeirra vegna skammtahrifa.
Yfir 99,94% af massa frumeindar er í kjarnanum. Róteindir eru jákvætt hlaðnar og nifteindir óhlaðnar svo kjarninn sjálfur er jákvætt hlaðinn. Rafeindirnar eru neikvætt hlaðnar og þessi gagnstæða hleðsla bindur þær við kjarnann. Ef fjöldi róteinda og rafeinda er jafn mikill, eins og oftast er, er frumeindin sjálf hlutlaust hlaðin. Ef rafeindirnar eru fleiri en róteindirnar fær frumeindin neikvæða hleðslu og nefnist neikvætt hlaðin jón (anjón eða forjón). Ef róteindirnar eru hins vegar fleiri fær frumeindin jákvæða hleðslu og nefnist jákvætt hlaðin jón (katjón eða bakjón).
Rafsegulkraftur dregur rafeindirnar að kjarnanum, meðan róteindir og nifteindir bindast með kjarnakrafti. Kjarnakrafturinn er oftast sterkari en rafsegulkrafturinn sem hrindir jákvætt hlöðnu róteindunum frá hver annarri. Undir vissum kringumstæðum verður rafsegulkrafturinn kjarnakraftinum yfirsterkari og kjarninn klofnar. Við það verða til tvö ný frumefni. Regluleg kjarnasundrun einkennir geislavirk efni.
Frumeindir geta bundist öðrum frumeindum með efnatengjum og myndað sameindir og kristalla. Sameindir ólíkra frumefna nefnast efnasambönd. Efnahvörf, þar sem frumeindir losna og bindast með ýmsum hætti, eru á bak við flestar umbreytingar sem verða í efnisheiminum. Efnafræði er fræðigrein sem fæst við rannsóknir á þessum breytingum.
Eiginleikar
[breyta | breyta frumkóða]Eiginleikar frumeinda eru aðallega ákvarðaðir út frá kjarna og rafeindaskýi þeirra, þar má nefna massa, hleðslu, kjarnakraft, geislun, seguleiginleika og ástand þeirra.
Frumeind má einnig skipta í tvo hluta: kjarna og rafeindasvigrúm. Rafeindasvigrúmið hýsir allar rafeindir frumeindarinnar og mynda rafeindirnar ský um kjarnann. Kjarninn er úr róteindum og nifteindum. Frumeind er sögð vera óhlaðin ef fjöldi róteinda og rafeinda er jafn. Annars kallast hún jón, og hefur jákvæða rafhleðslu ef róteindir eru fleiri en rafeindirnar, annars neikvæða hleðslu. Þótt ómögulegt sé að ákvarða samtímis bæði hraða og staðsetningu einstakra rafeinda með nákvæmni, má skipta rafeindaskýinu upp í hvolf eftir orkustigi rafeindanna. Hvolfin samsvara þá fjarlægð frá kjarnanum, þar sem hærra orkustig merkir meiri fjarlægð frá kjarnanum. Rafeindirnar leitast við að fylla orkulægri hvolfin, en hvert hvolf getur aðeins rúmað ákveðinn fjölda skv. reglunni 2n2 þar sem n er raðtala hvolfsins talið frá kjarna. Rafeindir sem sitja yst í tiltekinni frumeind nefnast gildisrafeindir og hafa mest áhrif á efnafræðilega hegðun hennar. Þær gegna lykilhlutverki í að binda frumeindir saman og mynda þannig sameindir. Efnishlutur sem eingöngu er úr einni tegund frumeinda kallast frumefni.
Sætistala frumefna ræðst af fjölda róteinda. Frumeindir sem hafa sömu sætistölu geta haft ólíkan fjölda nifteinda, þessar eindir eru kallaðar samsætur. Dæmi um þær eru til dæmis:
Kjarni
[breyta | breyta frumkóða]Hvert atóm hefur kjarna sem er úr kjarneindunum róteind og nifteind. Þessum eindum heldur sterki kjarnakrafturinn saman. Radíus kjarnans er u.þ.b. fm, þar sem A er fjöldi kjarneinda í kjarnanum. Þessi stærð er mun minni en heildarradíus atómsins sem er á stærðargráðunni 105 fm. Kjarninn er því aðeins brotabrot af heildarstærð atómsins, en næstum allur massi þess bundinn í honum. Massi rafeindanna er mun minni er massi kjarnans og yfirleitt ekki tekinn með í útreikningum sem varða atómið í heild.
Kjarneindirnar eru fermíeindir og því gildir einsetulögmál Paulis um þær. Það þýðir að hver róteind er með sitt eigið skammtaástand og deilir því ástandi ekki með annarri róteind. Sama gildir um nifteindirnar en þar sem þessar tvær kjarneindir hafa mismunandi hleðslu þá gildir einsetulögmálið ekki á milli þeirra.
Fjöldi róteinda ákvarðar sætistölu atómsins og þar með stöðu atómsins innan lotukerfisins. Hvert atóm getur haft mismunandi samsætur þar sem fjöldi nifteinda getur verið mismunandi en fjöldi kjarneinda ákveða kjarnagerðina.
Rafeindasvigrúm
[breyta | breyta frumkóða]
Umhverfis kjarnann eru rafeindir. Þessar rafeindir skiptast niður í svokölluð rafeindasvigrúm og sjá má fyrstu fimm svigrúmin á mynd hér til hliðar. Rafeindasvigrúmin hafa ákveðið rúmmál, sem eru háð skammtafræðilegum eiginleikum rafeindanna og er þær að finna innan þessa rúmmáls, en nákvæmlega hvar innan þess er ómögulegt að ákveða með tilraunum eða útreikningum (sjá óvissulögmál Heisenbergs). Aðeins er hægt, með skammtafræðilegum útreikningum, að reikna líkindi á staðsetningu og hraðavigur rafeindarinnar. Rafeindasvigrúmin eru kyrrstæð m.t.t. kjarna frumeindarinnar.
Saga
[breyta | breyta frumkóða]Grískir heimspekingar komu fyrstir fram með þá kenningu að allt efni væri gert úr ódeilanlegum eindum og nefndu þeir þessar eindir atomos. Það orð er sett saman úr a, sem er neitandi forskeyti og tomos, skurður, sem sagt eitthvað sem ekki er hægt að skera eða deila og lýsti þetta hugmynd þeirra um eðli þessara einda (atomos=ódeili). Demókrítos frá Abderu er sérstaklega bendlaður við þessa kenningu. Hér ber að undirstrika að þessar fyrstu hugmyndir um ódeilanlegar frumeindir eru í mikilsverðu tilliti frábrugðnar hugmyndum nútímamanna. Grísku frumeindasinnarnir hugsuðu sér að frumeindirnar væru í raun allar úr sama efninu en að þær skiptust í óendanlegan fjölda tilbrigða eftir stærð og lögun, þar sem eindir af hverju tilbrigði/tegund áttu að vera eilífar og óbreytanlegar. Stærð (þó alltaf örlítil) og lögun eindanna átti að ákvarða efnafræðilega eiginleika þeirra. Þetta áttu að vera grunneiningar alls hversdagslegs efnis, sem yfirleitt er hrærigrautur einda af mismunandi gerðum. Þó fyrirfinnast efnishlutir sem eingöngu eru úr eindum af tiltekinni gerð. Þetta átti t.d. að gilda um vatn, loft og eld. Þannig var hægt að tala um frumefni, þ.e.a.s efni sem aðeins væri úr eindum af tiltekinni gerð. En það er m.a. þetta atriði sem tengir þessi fornaldarfræði við nútímahugmyndir um frumeindir.
Spurningin um tilvist frumeinda/ódeila var mjög umdeild allt frá fornöld og fram á seinni hluta 19. aldar. Spurningin var alltaf nátengd efnafræði og snerist um það hvort frumefni væru til og þá hvort tiltekið frumefni væri úr ódeilanlegum frumeindum. Smám saman tókst þó að renna stoðum undir kenninguna um tilvist frumefna, t.d. með uppgötvun fosfórs á 17. öld og síðar súrefnis á 18. öld. Árið 1808 setti John Dalton síðan fram þá kenningu að frumefni væru samsett af einni gerð frumeinda, sem líkt og frumeindir Demokrítosar væru óbreytanlegar í lögun og byggingu. Önnur efnasambönd mætti síðan fá fram með því að blanda ólíkum frumefnum saman. Um miðja 19. öld vann rússneski efnafræðingurinn Mendelejev að því að búa til töflu eða kerfi frumefna sem byggðist á upplýsingum um atómmassa frumefna, en á þessum tíma höfðu menn ekki hugmynd um innri gerð atóma. Þetta kerfi kallast lotukerfi.
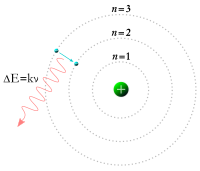
Af þessu má ljóst vera að það var helsta skilgreiningaratriði frumeinda/atóma að þær væru ókljúfanlegar, sbr. nafnið atomos. Það er því dálítið kaldhæðnislegt að þær tilraunir og uppgötvanir sem loks leiddu til þess að frumeindakenningin var tekin í sátt, sýndu beinlínis að frumeindirnar voru kljúfanlegar. Með uppgötvun rafeindarinnar undir lok 19. aldar fóru menn að velta því fyrir sér hvort fleiri eindir væru í atóminu og voru það einna helst uppgötvanir J. J. Thomson, Henri Becquerel og Ernest Rutherford sem ruddu brautina í þeim efnum. Árið 1896 uppgötvaði Becquerel geislavirkni og ári síðar uppgötvaði Thomson rafeindina. Rutherford tilkynnti svo um uppgötvun kjarnans árið 1911. Allan þennan gerjunartíma veltu menn því fyrir sér hvernig frumeindir væru uppbyggðar og hvernig þær viðhéldu stöðugleika. Loks tókst Niels Bohr, árið 1913, að setja fram líkan af vetnisfrumeindinni, sem skapaði grundvöll fyrir áframhaldandi starf og skilning á byggingu frumeinda. Ekki náðust myndir af atómum fyrr en með tilkomu rafeindasmásjárinnar á 20. öld.

![{\displaystyle {\begin{smallmatrix}1.07\cdot {\sqrt[{3}]{A}}\end{smallmatrix}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dbdc96c9208a88ea1f1692a6f6f6e4480843de24)